骨粗鬆症治療薬の種類とその選択 (2023年2月に使用できる薬剤のまとめ)
近年の骨粗鬆症治療の進歩はめざましく 骨吸収阻害薬 ・ 骨形成促進薬 とも に この2~3年で種類が増え 選択肢が豊富になった反面、最新の情報を漏れなく手に入れることが困難になって来ました。そこで2023年2月現在、入手使用できる骨粗鬆症治療薬剤についてまとめてみました。
骨粗鬆症においては閉経・ 加齢 ・ 不動 ・ ステロイドや各種薬剤などの種々の要因により骨吸収が骨形成を上回ることによっておこる骨量減少と酸化ストレスなどによる骨質の 劣化 ⑴が関係します。したがって骨粗鬆症の治療には骨吸収を抑制する方法と骨形成を促進させる方法、さらには骨質を改善する方法が考えられます。
A.骨吸収抑制薬の種類
骨吸収抑制薬に分類される薬剤には①ビスフォスフォネート製剤 ②選択的エストロゲン受容体モジュレーター( SERM) ③抗RANKL 抗体(デノスマブ)があげられます。
①ビスフォスフォネート製剤
第2世代に分類されるアレンドロン酸(フォサマック ® 、ボナロン ®)とイバンドロン酸 (ボンビバ ® )、第3世代に分類されるリセドロン酸 (アクトネル ® 、ベネット ®) 、ミノドロン酸 (ボノテオ ® )、ゾレドロン酸 (リクラスト ® )があります。
ビスフォスフォネート製剤は骨基質と親和性が強いため骨基質に蓄積し、それを破骨細胞が貪食するとビスフォスフォネートが破骨細胞内でコレステロール代謝を阻害して破骨細胞の分化を抑制します⑶。
ビスフォスフォネート経口剤は吸収が悪く、小腸から吸収されて血中に入るのは投与量の1 % にすぎません⑷。服用方法は朝食前に水で内服し、少なくとも、30分間は臥位をとらないようにします。
イバンドロン酸の静注製剤は直接血中に入るために経口製剤のように吸収率の悪さを考慮する必要はありませんが、投与後30%ぐらいの患者に筋肉痛・骨痛・関節痛・発熱・全身倦怠感などのインフルエンザ様の症状が時に副作用として見られることがあります(投与後 1~3 日以内に発生し、自然消失します)。骨折予防効果はアレンドロン酸、リセドロン酸、ゾレドロン酸はともに椎体骨折を 50~70%、大腿骨近位部骨折を 40%、非椎体骨折を 20~30%減少させます⑸。
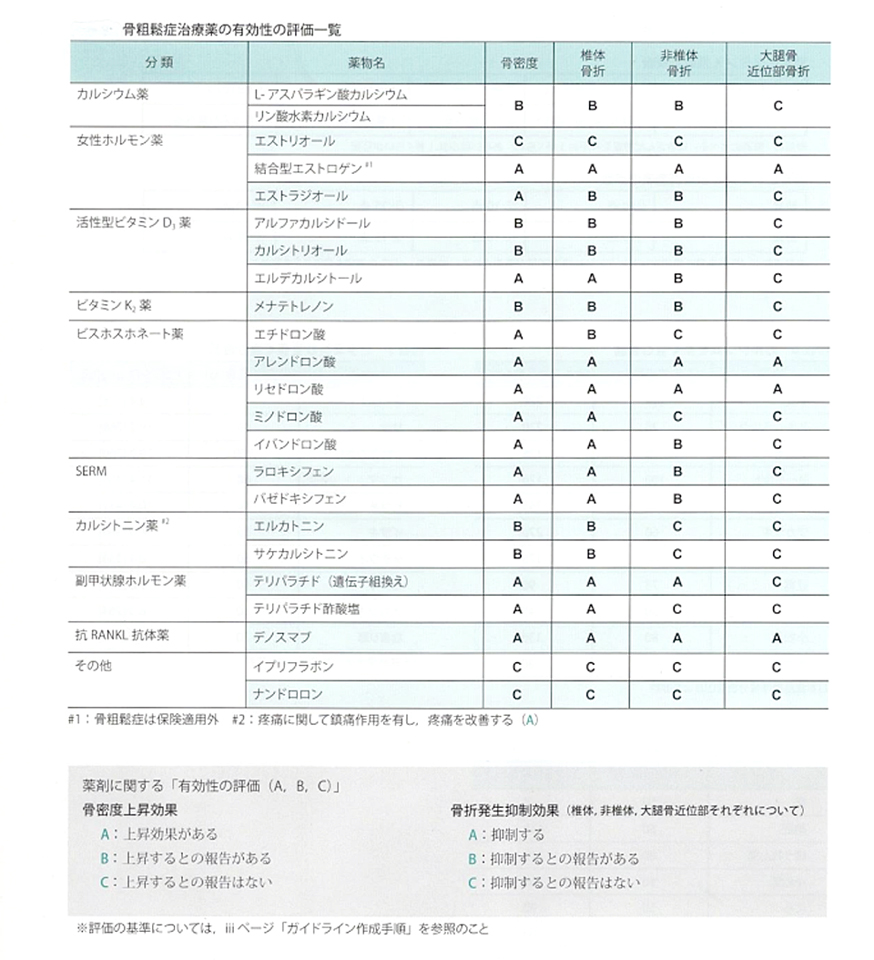
しかしビスフォスフォネート製剤はすべて同じ効果というわけではなく、ミノドロン酸、イバンドロン酸は椎体骨折のみに有効です⑸(図 1)。
ビスフォスフォネート製剤の効果消失までの期間は骨との親和性によって決まり、製剤によって異なります。イバンドロン酸は数ヶ月、リセドロン酸は 1~2 年、ゾレドロン酸は 5 年以上続きます⑹。
ビスフォスフォネート製剤は腎障害( eGFR30以下)があると慎重投与が必要です。
骨吸収抑制薬による重大な副作用はまれですが、顎骨壊死と非定型大腿骨骨折があります。非定型大腿骨骨折の多くは大腿骨転子下の横骨折で軽度の外傷で発生します。予防にはビスフォスフォネート製剤を 5 年内服したら休薬期間(drug holiday)を設けます。その期間はアレンドロン酸 1~2 年、リセドロン酸 0.5~1 年、ゾレドロン酸 3 年です⑻。
②選択的エストロゲン受容体モジュレーター(SERM)
更年期以降に内因性エストロゲンが低下することが骨粗鬆症の原因の一つでありますが、SERM は骨に対してはエストロゲンと同様の骨吸収抑制作用を有する一方で子宮内膜や乳腺では抗エストロゲン作用を示し、乳がん発症を抑制する可能性も指摘されています⑼。
SERM として日本ではラロキシフェン(エビスタ®)とバゼドキシフェン(ビビアント®)が承認されています。
ビスフォスフォネート製剤やデノスマブに比べて骨密度増加効果は少なく、椎体骨折リスクは減らしますが非椎体骨や大腿骨近位部の骨折抑制効果は示されていません⑸。SERM の骨折抑制効果は骨密度上昇との相関が弱く、主に骨質の改善によるものと考えられています⑴。
注意すべき副作用として下肢深部静脈血栓症のリスクが使用していない人に比べて 3 倍になることがあげられます⑼。
③デノスマブ(プラリア®)
デノスマブは骨細胞由来の破骨細胞活性化因子である RANKLを標的とした完全ヒト型モノクローナル抗体です。RANKL を阻害することで破骨細胞の形成を抑制します。
デノスマブは半減期が1ヶ月前後と長く、半年に1回の皮下投与で十分な骨吸収抑制効果が得られます。
デノスマブによる骨密度増加はビスフォスフォネート製剤による増加より大きく その効果は 10 年にわたり続き、投与 3 年後の骨折予防効果は全骨折を抑制し、椎体骨折を 68%、大腿骨近位部骨折を 40%、非椎体骨折を 20% 減少させます⑽。
薬剤そのものは腎代謝ではありませんが、高度の腎障害がある場合は低カルシウム血症をおこす可能性があり注意が必要です。ビスフォスフォネート製剤と同じく、関与が疑われている副作用として顎骨壊死や非定型大腿骨骨折があります。
デノスマブの最大の問題は薬剤中止後 蓄積されていた破骨細胞が一気に分化するため急速な骨吸収亢進がおこることです。
このため薬剤中止後 12 ヶ月で椎体骨折が多発することが報告されています⑾。
できるかぎり投与を続けるべきですが、やむを得ず中止する時にはビスフォスフォネート製剤に変更すると骨量減少をある程度抑え骨折発生を抑えられるという報告⑿があります。しかし効果は一定していません。
デノスマブ中止後 テリパラチド(PTH)に移行すると橈骨・股関節周辺の著明な骨量減少がおこるという報告があり、使用すべきではないとされています⒀。
B.骨形成促進薬の種類
骨形成促進が主作用で日本で認可されている骨粗鬆症治療薬はテリパラチド(フォルテオ皮下注®、テリボン皮下注®)、 ロモソズマブ(イベニティ皮下注®)、 アバロパラチド(オスタバロ皮下注®)の 3 種類です。
①テリパラチド、アバロパラチド
テリパラチドは遺伝子組み換えヒト副甲状腺ホルモン(PTH)でアバロパラチドは PTH 関連ペプチドの誘導体でともに PTH 様作用を示します。PTH 投与で PTH レセプター活性化が持続的に起こると一次性副甲状腺機能亢進症の様に骨吸収が優勢になり骨量が減少しますが、持続的でなく毎日またはそれ以下の頻度では骨量が特に海綿骨で増加します。
両者ともに副作用は吐気・めまい・頭痛・動悸が主です。ラットで骨肉腫をおこすというデータ(ヒトではない)があるため テリパラチドは 24 ヶ月、アバロパラチドは 18 ヶ月という使用制限があります。
両者ともに椎体骨折は 80%以上減少させますが、非椎体骨折とくに大腿骨近位部骨折にはあまり効果がありません⒂(図 1)。
つまり PTH 製剤の骨量増加は椎体のみで非椎体 とくに大腿骨近位部での骨量増加は期待できません。
②ロモソズマブ(抗スクレロスチン抗体)
スクレロスチンとは骨表面で骨細胞から放出されるタンパクで骨芽細胞による骨形成を抑制し 破骨細胞による骨吸収を増加させて骨量増加を阻害します。ロモソズマブはこのスクレロスチンに結合して骨形成を促進し、骨吸収を抑制します。ロモソズマブは骨形成促進作用 と骨吸収抑制作用 を同時 に発揮します。
骨折予防効果は椎体骨折・非椎体骨折および大腿骨近位部骨折すべてを強力に抑制し、骨吸収抑制剤よりも予防効果があります⒂。
治療効果は投与後 1 年間は骨量の増加が続きますが⒃、治療2年目以降は骨量増加は頭打ちとなるため連続投与期間は1年となっています。しかし投与を中止すると骨密度の低下がおこってくるのでデノスマブやゾレドロン酸などの骨吸収抑制剤の投与が必要です⒅。
ロモソズマブは骨吸収抑制効果も有するため テリパラチドには見られない顎骨壊死や非定型大腿骨骨折という薬剤の関与を疑われる副作用もあるほか、心血管 イベント(心筋梗塞や脳梗塞 )の副作用 が報告され、添付文書 にも「有益性投与 」の記載が追加 されました。心筋梗塞や脳梗塞などの血栓症 の既 往 がある場 合 や動 脈 硬 化 のリスクが高 い方 は使用を避けたほうがよいと考えられます。
C.その他の薬剤、サプリメント
①カルシウム製剤 、サプリメント
従来は 1 日のカルシウム 500mg 以上の摂取が推奨されて来ましたが、65 歳以上の女性で骨量とカルシウム摂取量の間には相関はなく⒆、カルシウムのサプリメントの摂取は成人で骨折を予防せず胃腸障害・腎結石・心血管疾患を増加させるのでカルシウムの摂取は食事からだけにすべきとの報告があります⒇。
②ビタミン D
ビタミン D には天然型 と活性型がありますが、天然型 ビタミン D は食事 として摂取 されるものと皮膚で紫外線をあびて合成されるものとがあります。天然型 ビタミン Dは肝臓 、腎臓で代謝 されて活性型ビタミンDとなります。現在骨粗鬆症治療薬 として処方されているのは活性型です。天然型 ビタミンDの高用量は骨量減少 を加速 し、さらに転倒 ・骨折を増やすことがわかっています(21)。活性型 ビタミン D は腸管からのカルシウム吸収 を高め、骨量 を増やすと言 われています。また骨 以 外 にも作 用 し 癌 ・ 炎症 ・免疫・心血管・皮膚・筋肉 への作 用 が報 告 されています(22)。骨格筋にはビタミン D 受容体が分布 しており、Ⅱ型筋線 維 へ作 用 することにより体 幹 の揺 れが減 少 し、転倒を抑制することが明 らかになっています(23)。
活性型 ビタミン D3 ではアルファカルシドールが多 く用いられていましたが、近年 さらに強力な骨量増加作用 を目的として合 成 されたエルデカルシトール( エディロール ® ) は消 化 管 からのカルシウム吸 収 促 進 作 用 に加 えて骨吸収を抑制 する作用 を示し、アルファカルシドールに比較して有意 に骨量 を増加させ椎体骨折の抑制効果を示しました(活性型 ビタミン D3 製剤において唯一 A 評価 )(24)(図1)。副作用 としては血清カルシウム濃度の上昇や尿路結石があります。
(骨粗鬆症治療においてどちらを先に使 うべきか?)
近年 骨折のリスクが高い重症の骨粗鬆症には骨形成促進薬で得られる骨密度増加の量とスピードが骨吸収抑制薬を使った場合より大きいことなどから早急な骨密度・骨強度の上昇を目指して骨形成促進薬を先に用いる傾向にあります(25)(26)。しかし骨密度は加齢とともに減少して行く一方で、骨形成促進薬は1~2年間の使用しかできないので骨吸収抑制薬による治療継続が重要です。
(図 1.骨粗鬆症治療薬の有効性の評価一覧 )
(参考文献)
1. Saito M, Marumo K, Effects of collagen crosslinking on bone material properties in health and disease. Calcif Tissue Int 97:242-261, 2015
2.Tanaka S, Molecular understanding of pharmacological treatment of osteoporosis. EFORT Open Rev 4: 158-164, 2019
3.Zhu H, Tamura A, et al., Mitigating RANKL-induced cholesterol overload in macrophages with β -cyclodextrin-threaded polyrotaxanes suppresses osteoclastogenesis. Biomater Sci 10:
5230-5242, 2022
4.Nakai K, Tobinai M, et al., The optimal oral dose selection of ibandronate in Japanese patents with osteoporosis based on pharmacokinetic and pharmacodynamic properties. Eur J Drug Metab Pharmacokinet 41:139-147, 2016
5.Davis S, Simpson E, et al., Denosumab, raloxifene, romosozumaband teriparatide to prevent osteoporotic fragility fractures : a systematic review and economic evaluation. Health Technol Assess 24:1-314, 2020
6.Reid IR, Horne AM, et al., Fracture prevention with zolendronate in older women with osteopenia. N Engle J Med 379: 2407 -2416, 2018
7.Robinson DE, Ali MS, et al., Safety of oral bisphosphonates in moderate-to-severe chronic kidney disease: a bi-national cohort analysis. J Bone Miner Res 36: 820-832, 2021
8.Black DM, Geiger EJ, et al., Atypical femur fracture risk versus fragility fracture prevention with bisphosphonates. N Eng J Med 383: 743-753, 2020
9.Ettinger B, Black DM, et al., Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. JAMA 282: 637-645,1999
10.Cummings SR, San Martin J, et al., Denosumab for prevention of fractures in postmenopausal women with osteoporosis. NEngl J Med 361: 756-765, 2009
11.Commings SR, Ferrari S, et al., Vertebral fractures after discontinuation of denosumab: a post hoc analysis of the randomized placebo-controlled FREEDOM trial and its extension. J Bone Miner Res 33: 190-198, 2018
12.Solling AS, Harslof T, et al., Treatment with zoledronate subsequent to denosumab in osteoporosis: a 2 -year randomized study. J Bone Miner Res 36: 1245-1254, 2021
13.Leder BZ, Tsai JN, et al., Denosumab and teriparatide transitions in postmenopausal osteoporosis( the DATA-Switch study ): extension of a randomized controlled trial. Lancet 386: 1147-1155, 2015
14.Kendler DL, Martin F, et al., Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis( VERO ): a multicentre, double -blind, double-dummy, randomized controlled trial. Lancet 391: 230 -240, 2018
15.Diez-Perez A, Martin F, et al., Effects of teriparatide on hip and upper limb fractures in patients with osteoporosis: a systematic review and meta-analysis. Bone 120: 1-8, 2019
16.Lewiecki EM, Blicharski T, et al., A phase Ⅲ randomized placebo-controlled trial to evaluate efficacy and safety of romosozumab in men with osteoporosis. J Clin Endocrinol Metab 103: 3183-3193, 2018
17.Kendler DL, Bone HG, et al., Bone mineral density gains with asecond 12-month course of romosozumab therapy following placebo or denosumab. Osteoporosis Int 30: 2437-2448, 2019
18.McClung MR, Bolognese MA, et al., A single dose of zoledronate preserves bone mineral density for up to 2years after a second course of romosozumab. Osteoporosis Int 31: 2231 -2241, 2020
19.Bristow SM, Horne AM, et al., Dietary calcium intake and bone loss over 6years in osteopenic postmenopausal women. J Clin Endocrinol Metab 104: 3576-3584, 2019
20.Zhao JG, Zeng XT,et al., Association between calcium or vitamin D supplementation and fracture incidence in community -dwelling older adults: a systematic review and meta-analysis. JAMA 318: 2466-2482, 2017
21.Smith LM, Gallagher JC, et al., Medium doses of daily vitamin D decrease falls and higher doses of daily vitamin D3 increase falls: a randomized clinical trial. J Steroid Biochem Mol Biol 173: 317-322, 2017
22.Pfeifer M, Begerow B, et al., Vitamin D status, trunk muscle strength, body sway, falls and fractures among 237 postmenopausal women with osteoporosis . Exp Clin Endocrinol Diabetes 109(2): 87-92, 2001
23.Stein MS, Wark JD, et al., Falls relate to vitamin D and parathyroid hormone in an Australian nursing home and hostel. J Am Geriatr Soc 47(10): 1195-1201, 1999
24.Matsumoto T, Ito M, et al., A new active vitamin D3 analog, eldecalcitol, prevents the risk of osteoporotic fractures: a randomized, active comparator, double-blind study. Bone 49: 605-612, 2011
25.Langdahl B, Treatment of postmenopausal osteoporosis with bone-forming and antiresorptive treatments: combined and sequential approaches. Bone 139: 115516, 2020
26.McClung MR: Romosozumab for the treatment of osteoporosis. Osteoporosis Sarcopenia 4: 11-15, 2018
( 2023.02.22 )